VIDEO:
PDF:
Descaragar PDF

DESPOLARIZACIÓN
Las
células del sistema de His-Purkinje y los miocitos ventriculares expresan
cantidades relativamente elevadas de conductos de Na+ controlados por voltaje,
además de conductos de Ca2+ de tipo L y varios conductos de K+. Los conductos
de Na+ tienen un umbral de voltaje muy bajo, de forma que son los primeros
conductos iónicos controlados por voltaje que se abren conforme se despolariza
la membrana del miocito. En estado de actividad, los conductos de Na+ conducen
grandes cantidades de Na+ hacia el interior de la célula. Este incremento
rápido y grande de Na+ en la célula causa despolarización rápida (conocida como
fase 0 del potencial de acción) que dura sólo unos cuantos milisegundos,
después de lo cual los conductos de Na+ cambian con rapidez del estado activo
al estado cerrado (de inactividad). La despolarización rápida de la membrana
del miocito causada por la corriente de Na+ hacia el interior de la célula
causa la abertura secuencial de otros conductos iónicos controlados por
voltaje, lo que incluye los conductos de Ca2+ de tipo L y diversos conductos de
K+. Una fase de repolarización de corta duración (conocida como fase 1) después
de la fase de despolarización rápida es consecuencia de la abertura de los
conductos de K+.
FASE DE MESETA
La fase
de meseta (conocida como fase 2) del potencial de acción se debe principalmente
a la entrada de corrientes de despolarización a través de conductos de Ca2+ de
tipo L controlados por voltaje. La entrada de Ca2+ a través de los conductos de
Ca2+ de tipo L induce la abertura del receptor de rianodina (RyR) para la abertura
y liberación de Ca2+ del retículo sarcoplásmico (ESR), un proceso conocido como
liberación de calcio inducida por calcio (CICR). El incremento en el Ca2+
intracelular es el causante de la interacción de las proteínas contráctiles
dependientes de Ca2+, lo que ocasiona la contracción del miocito ventricular.
REPOLRIZACIÓN
Hacia el
final de la fase de meseta del potencial de acción, las corrientes de
repolarización de "rectificación tardía" son consecuencia de los
desplazamientos de iones de K+ a través de la célula por medio de conductos de
K+; estas corrientes de K+ hacia el interior de la célula incrementan con el
tiempo conforme se inactivan los conductos de Ca2+. Este flujo de K+ hacia el
interior de la célula da origen a incremento en la fase de repolarización del
potencial de acción (conocida como fase 3). La eliminación del Ca2+
intracelular ocurre en la bomba de Ca2+ que requiere ATP, conocida como SERCA
(ATPasa de calcio del retículo sarco-endoplásmico), que desplaza iones de Ca2+
a los sitios de almacenamiento en el retículo sarcoplásmico y el intercambiador
de Na+-Ca2+ utiliza gradientes electroquímicos para expulsar iones de Ca2+ en
intercambio por iones de Na+, que se desplazan hacia el interior de la célula.
La disminución de Ca2+ intracelular ocasiona la relajación del miocito
cardiaco.
ESTADO DE REPOSO
Conforme
el potencial de membrana regresa al voltaje de reposo durante la fase de
repolarización del potencial de acción, los conductos de Na+ se recuperan del
estado de inactividad al estado de reposo. El proceso de recuperación depende
del voltaje y puede ser alterado por diversos fármacos antiarrítmicos, como se
describe en la siguiente sección. Otro factor que contribuye a la corriente de
repolarización es la bomba iónica que depende de ATP, la Na+- K+ -ATPasa que
introduce iones de K+ a la célula y expulsa iones de Na+, con lo que se
restablece el Na+ y K+ a sus concentraciones de reposo en el interior de la
célula. La reducción en la velocidad de recuperación de los conductos de Na+ a su
estado de reposo ocasiona incremento en el periodo refractario de los miocitos
ventriculares, haciendo menos probable que estas células se despolaricen si son
estimuladas de manera prematura.
RESUMEN
• Las
células del sistema de His-Purkinje causan despolarización de los miocitos
ventriculares adyacentes.
• Los
conductos de Na+ controlados por voltaje se abren primero, ocasionando una
rápida despolarización de la membrana de los miocitos (fase 0).
•
Inactivación (cierre) rápido de los conductos de Na+.
• Abertura
de los conductos de K+, lo que causa repolarización rápida de la membrana del
miocito (fase 1).
•
Abertura de los conductos de Ca2+ de tipo L cuando su umbral de voltaje se
alcanza y permanece abierto por un tiempo relativamente largo (fase 2).
• CICR:
la entrada de Ca2+ al interior de la célula induce que los RyR liberen Ca2+ del
retículo sarcoplásmico.
•
Contracción: altas concentraciones de Ca2+ causan la activación de las
proteínas contráctiles del miocito.
• Cierre
de los conductos de Ca2+ de tipo L y RyR.
• El Ca2+
se elimina del citoplasma por la acción de SERCA y de intercambiadores de
Na+/Ca2+.
•
Relajación: disminución de las concentraciones de Ca2+ que causa la relajación
de las proteínas contráctiles.
•
Abertura de los conductos de K+ de rectificación tardía y repolarización de la
membrana celular (fase 3).
• Los
gradientes de Na+ y de K+ se restablecen por acción de la bomba de Na+- K+
-ATPasa.
• Los
conductos de Na+ regresan al estado de reposo.
Antagonistas de los Conductos de Na+
Diversos
fármacos que antagonizan los conductos de Na+ se utilizan para el tratamiento
de taquicardias ventriculares como el flúter auricular y la fibrilación
ventricular. Los antagonistas de los conductos de Na+ se conocen como fármacos
antiarrítmicos de clase I. Tales fármacos se unen a los conductos de Na+ en una
forma dependiente del estado y antagonizan la entrada de Na+ hacia los miocitos
cardiacos. Estos fármacos se unen con gran afinidad a estados de actividad e
inactividad de los conductos de Na+ y los miocitos en los que ejercen sus
efectos, se despolarizan con mayor rapidez de lo normal. Los fármacos
antagonistas de los conductos de Na+ se clasifican con base en la velocidad con
que se disocian del conducto, una propiedad conocida como tiempo de recuperación.
La lidocaína es un fármaco antiarrítmico con tiempo de recuperación muy corto,
mucho menos de 1 s (tiempo de recuperación) y por tanto sólo inhibe los
conductos de Na+ en miocitos de despolarización muy rápida. Por el contrario,
la flecainida y propafenona son fármacos antiarrítmicos que se disocian con
gran lentitud de los conductos de Na+. La constante de tiempo para la
recuperación de la función del conducto de Na+ para estos fármacos es de más de
10 s (tiempo de recuperación). Estos fármacos se disocian con gran lentitud de
los conductos de Na+, y por tanto tiene efectos sobre los miocitos en
despolarización normal y rápida. Tales medicamentos disminuyen el umbral para
la excitabilidad de forma tal que es necesaria mayor despolarización de la membrana
para ocasionar abertura de los conductos de Na+ desde el estado en reposo. Esto
ocasiona disminución de la automaticidad. Como se disocian con gran lentitud de
los conductos de Na+, dichos fármacos también prolongan el periodo refractario
efectivo (ERP). Ambos efectos farmacológicos, la reducción de la automaticidad
y la prolongación del periodo refractario, son mecanismos de acción importantes
de los antiarrítmicos. Al inhibir la entrada de Na+ hacia los miocitos
cardiacos, también reducen la velocidad de conducción a través de las aurículas
y ventrículos. La disminución de la conducción causa prolongación del intervalo
PR y ensanchamiento del complejo QRS en el trazo electrocardiográfico (ECG).
Antagonistas de los Conductos de K+
La
amiodarona, dofetilida e ibutilida son antiarrítmicos de clase III que
prolongan la duración del potencial de acción (APD) principalmente a través del
antagonismo de la salida de K+ a través de los conductos "rectificadores
tardíos" de K+ (conocidos como IKr). La dofetilida es un antagonista
"puro" de los conductos de K+, mientras que la amiodarona e ibutilida
tienen efectos farmacológicos adicionales que contribuyen a sus propiedades
antiarrítmicas. La inhibición de la salida de K+ a través de los conductos de
K+ hace más lenta la repolarización (fase 3) y prolongan el potencial de
acción. La prolongación de la duración del potencial de acción (APD) hace más
lenta la recuperación dependiente de voltaje de los conductos de Na+ en estado
de reposo, lo que incrementa el período refractario efectivo (ERP) de los
miocitos cardiacos. El efecto de la duración del potencial de acción prolongado
(APD) se manifiesta en el trazo electrocardiográfico (ECG) por prolongación del
intervalo QT por una repolarización más lenta de los miocitos ventriculares. La
repolarización de los miocitos auriculares no se observa en el trazo
electrocardiográfico.
Agonistas Adrenérgicos Beta
La
noradrenalina (NE) y adrenalina (Epi) liberadas por el sistema nervioso
simpático, incrementan la fuerza de contracción auricular y ventricular al
activar los receptores adrenérgicos β en los miocitos auriculares y
ventriculares. Se obtienen efectos similares, pero de mayor duración con la
administración de fármacos agonistas β como la dobutamina. La activación de los
receptores adrenérgicos β da origen a la activación de la adenilil ciclasa, que
estimula la producción de cAMP. El incremento en las concentraciones
intracelulares de cAMP causa activación de la proteína cinasa A (PKA), una
enzima que cataliza la incorporación del fosfato en varias proteínas en los
miocitos, lo que incluye los conductos de Ca2+ de tipo L, receptor de rianodina
(RyR) y fosfolambano (PL), una proteína en la membrana del retículo
sarcoplásmico que inhibe parcialmente el receptor de rianodina. El resultado de
estas fosforilaciones es la entrada de mayor cantidad de calcio a las células a
través de los conductos de Ca2+ de tipo L, más liberación de calcio del
retículo sarcoplásmico por el receptor de rianodina y más calcio bombeado de nuevo
hacia el retículo sarcoplásmico por SERCA. Tales cambios en el calcio dan
origen a incremento de la fuerza de contracción por aumento de la cantidad de
calcio suministrado al aparato de contracción durante cada despolarización del
miocito y un incremento en la tasa de relajación del miocito después de la
contracción por aumento en la recaptación de Ca2+ hacia el retículo
sarcoplásmico.
Inhibidores de la Fosfodiesterasa
Los
inhibidores de la fosfodiesterasa (PDE) como la inamrinona y milrinona actúan
como fármacos inotrópicos al inhibir las enzimas en los miocitos que desdoblan
cAMP. Esto ocasiona incremento en el cAMP intracelular en los miocitos que han
sido activados por la adenilil ciclasa por agonistas adrenérgicos β. El
incremento en cAMP ocasiona la activación de la proteína cinasa A (PKA) con
fosforilación subsiguiente de los conductos de Ca2+ de tipo L, receptor de
rianodina (RyR) y fosfolambano (PL). La fuerza de contracción se incrementa por
un mayor suministro de Ca2+ al aparato contráctil y la tasa de relajación de
miocitos hace más rápida porque se bombea Ca2+ hacia el retículo sarcoplásmico
con mayor rapidez.
Digoxina
La digoxina es un fármaco
inotrópico que incrementa las concentraciones intracelulares en el miocitos de
Ca2+ a través de un mecanismo indirecto que implica al Na+. La digoxina se une
e inhibe la bomba de Na+- K+ -ATPasa. La inhibición de la bomba no elimina Na+
tan rápido de la célula, lo que causa que se acumule Na+ en el miocito con lo
que se reduce el gradiente de Na+ a través de la membrana celular. El gradiente
de Na+ determina la tasa de eliminación de Ca2+ de la célula por un
intercambiador de Na+/Ca2+, uno de los principales mecanismos para el
desplazamiento de Ca2+ fuera del miocito. La disminución del gradiente de Na+
reduce la tasa de eliminación de Ca2+, de forma que el Ca2+ causa
despolarización, más Ca2+ se libera del retículo sarcoplásmico y alcanza el
aparato contráctil; esto incrementa la fuerza de contracción de los miocitos
auriculares y ventriculares.
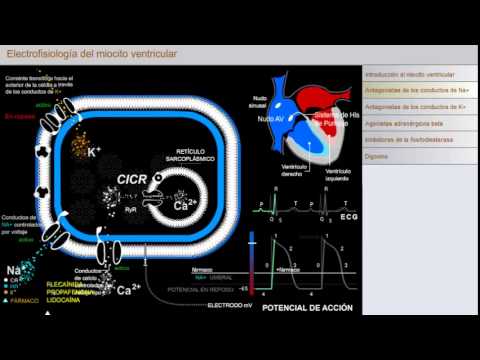 Aquí se revisa la electrofisiología de los miocitos ventriculares y los efectos farmacológicos de los medicamentos utilizados para el tratamiento de arritmias ventriculares e insuficiencia cardiaca. Los fármacos antiarrítmicos e inotrópicos actúan al alterar los desplazamientos de iones hacia el interior y exterior del miocito ventricular. El desplazamiento de iones a través de membranas celulares ocurre a través de conductos iónicos específicos, por medio de intercambiadores y por transportadores que bombean iones contra el gradiente eléctrico y de concentración. El potencial de acción de membrana registrado en los miocitos ventriculares refleja la suma de los desplazamientos iónicos a través de diversos conductos iónicos, transportadores e intercambiadores. Los impulsos de despolarización generados por el nudo sinusal se propagan con rapidez a través de los miocitos auriculares, más tarde se mueve con lentitud a través del nudo AV antes de alcanzar el sistema de His-Purkinje en los ventrículos. Las células del sistema de His-Purkinje conducen con rapidez el impulso de despolarización a los miocitos ventriculares en el vértice del corazón. La onda de despolarización se desplaza con rapidez a través de los miocitos ventriculares hacia la base del corazón. Esta secuencia de despolarización celular en los ventrículos causa la contracción ventricular que bombea de manera eficiente la sangre fuera del corazón y hacia la aorta y arteria pulmonar.
Aquí se revisa la electrofisiología de los miocitos ventriculares y los efectos farmacológicos de los medicamentos utilizados para el tratamiento de arritmias ventriculares e insuficiencia cardiaca. Los fármacos antiarrítmicos e inotrópicos actúan al alterar los desplazamientos de iones hacia el interior y exterior del miocito ventricular. El desplazamiento de iones a través de membranas celulares ocurre a través de conductos iónicos específicos, por medio de intercambiadores y por transportadores que bombean iones contra el gradiente eléctrico y de concentración. El potencial de acción de membrana registrado en los miocitos ventriculares refleja la suma de los desplazamientos iónicos a través de diversos conductos iónicos, transportadores e intercambiadores. Los impulsos de despolarización generados por el nudo sinusal se propagan con rapidez a través de los miocitos auriculares, más tarde se mueve con lentitud a través del nudo AV antes de alcanzar el sistema de His-Purkinje en los ventrículos. Las células del sistema de His-Purkinje conducen con rapidez el impulso de despolarización a los miocitos ventriculares en el vértice del corazón. La onda de despolarización se desplaza con rapidez a través de los miocitos ventriculares hacia la base del corazón. Esta secuencia de despolarización celular en los ventrículos causa la contracción ventricular que bombea de manera eficiente la sangre fuera del corazón y hacia la aorta y arteria pulmonar.
![LIBRO | Fisiopatologia - Porth 7ed [ESPAÑOL] [PDF] LIBRO | Fisiopatologia - Porth 7ed [ESPAÑOL] [PDF]](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEimjbL6LT_Z6d7Eu0E1yC6b2onCRoZtDwVpjEt35wdoXJs9ILNxAsP5_XNCdl5TapQ9TnvReb_aEPQgj20IfvVx5CuNL0aZathiFRcaxP_9WETriXKmL6CgcaWhnZVA9ef6k0qJpaWKynMJ/s72-w482-c-h591-no/1.jpg)
![LIBRO | Fisiopatologia - Porth 9ed [ESPAÑOL] [PDF] LIBRO | Fisiopatologia - Porth 9ed [ESPAÑOL] [PDF]](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEi79OPTpVDjhWmNUjxiGBU-hC2JxPmpdfNR0wdyv_ftkeZO1PBSMcjwwpHQcUHSRnNdjMmiIsnKgh4yYE-0BlNrtrAax3dRTS3baRrXnt_PjmsEBzFWnkhvUOK2wA6SJYRR1ppNYHTBV6s/s72-c/porth.jpg)
![LIBRO | Rumack - Diagnostico por Ecografia 3ra Ed Tomo 1 [ESPAÑOL] [PDF] LIBRO | Rumack - Diagnostico por Ecografia 3ra Ed Tomo 1 [ESPAÑOL] [PDF]](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEj7TL7kFXNMJSZA8cAH-gH3RSpii2LbH2Au25HyqjWdfId5D_kF-_RZIMZeSdJJGkYRKwY1vBab9vS0xnatB1rvXHJ2kBvaBk4e868EHWZ_xj9SMcaH5Nvo1lr7glUHYuv3HMmtmpWNy0lS/s72-w306-c-h400-no/1.jpg)
![LIBRO | Microbiologia Medica - Murray 7ma Ed [ESPAÑOL] [PDF] LIBRO | Microbiologia Medica - Murray 7ma Ed [ESPAÑOL] [PDF]](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEisquvrRk6C-WfZIvx7QfTV-6WL0lqOuSBUJ589hpujlQi2rxQKdQzxDKZEJYqxzz4-Zug7lSQKw_BuhcuYK8KhIYD4V1k5PuDp1fe6T0mJdixY0snkxzHj8ahFMoTN3YyJC9j1yjee0_I/s72-c/Microbiologia.jpg)
![LIBRO | Goodman Gilman Las Bases Farmacológicas de la Terapéutica 12ed [ESPAÑOL] [PDF] LIBRO | Goodman Gilman Las Bases Farmacológicas de la Terapéutica 12ed [ESPAÑOL] [PDF]](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEgUSn8akiMDV9L1ULfhk_ia031b25f9kF_BUy7_avmG16Y2QBGdHKC58Sms0MoNukK5SPnbFvS32LtxDfoxBDgaTC30vQTrXv7jvjUisAFjjXcH5Hm1Vv_AKrIZEBB9naUpfW1v-I2KosFz/s72-w455-c-h591-no/goodman.jpg)
![LIBRO | Dermatología - Fitzpatrick 7ed (Tomo 1) [ESPAÑOL] [PDF] LIBRO | Dermatología - Fitzpatrick 7ed (Tomo 1) [ESPAÑOL] [PDF]](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEh_wYW6m9TkrkJ5XuFxXHMMm-_K1pEBgv_vqj3xatUwX4zLsFEnS3SzonOCyNZQrSzczFZQgiw34soMf6vd_wog1wBXqVOHSuWLyDQwxtq5UXZeMKfkCgpjwJdIjz76IHXVqBUSksFzW7Q/s72-c/Fitzpatrick.jpg)

![LIBRO | Neurología - Zarranz 5ed [ESPAÑOL] [PDF] LIBRO | Neurología - Zarranz 5ed [ESPAÑOL] [PDF]](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEhkDSsoVvCseluT7N7anR_h1DK58lNVtVx5Vklbocu77zECw49tjocrQ-F8eKq6xjRbWE-JEaOTd5APklmRHSFK0s2QFT_I6r8P6MnXzCmcW0RSPkjrm1FyCtYGjeocDfFCDIi5OLdm1WXJ/s72-c/ZARRANZ.jpg)
